Хроматографія - це метод розділення сумішей на складові їх речовини, заснований на відмінності в ступені приймальності окремих речовин при проходженні їх через шар поглинача.
Хроматографія використовується для якісного та кількісного визначення речовин у сумішах різного роду, в діагностичних цілях (наприклад, зміни вмісту окремих амінокислот у плазмі крові, тканинах печінки та інших органів, що наступають при цілому ряді патологічних станів, і т. д. і т. п.), а також для препаративних цілей при отриманні багатьох, в тому числі і біологічно активних, речовин.
У клінічних, санітарно-гігієнічних та фармацевтичних лабораторіях широко застосовуються наступні види хроматографії.
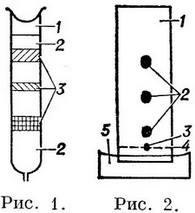 Рис. 1 Колоночная хроматографія: 1 - досліджуваний розчин; 2 - шар сорбенту; 3 - зони, що утворюються речовинами, що входять до складу аналізованої суміші. Рис. 2. Хроматографія на папері: 1 - паперова смужка; 2 - пофарбовані плями, відповідні різним речовинам, які входили до складу аналізованого розчину; 3 - крапля аналізованого розчину; 4 - лінія старту; 5 - розчинник. |
Колоночная хроматографія - здійснюється пропущенням досліджуваного розчину, що містить кілька розчинених речовин, через скляну трубку (колонку - рис. 1)заповнену порошкоподібною поглиначем (сорбентом). Внаслідок неоднакової приймальності (сорбованості) різних речовин відбувається їх поділ. Чим краще поглинається речовина, тим в більш високих частинах колонки воно затримується. Визначення природи речовини виробляють або за власною характерною забарвленням речовини, або пропусканням через колонку (після розділення суміші) розчину реагенту - проявника, що утворює з аналізованими речовинами специфічно забарвлені сполуки. Отриманий таким чином шар сорбенту з різно забарвленими зонами називають хроматограмою. Речовини, що сорбовані на колонці, можуть бути послідовно витіснені (вимиті) і зібрані по фракціям. Цей процес називають элюцией.
Паперова хроматографія - проводиться на смужках спеціальних сортів паперу. Крапля досліджуваного розчину наноситься на деякій відстані від краю паперової смужки (рис. 2). Край смужки поміщають у відповідний розчинник, який переміщається по капілярах паперу вздовж смужки. При цьому відбувається поділ речовин: чим гірше речовина поглинається, тим далі буде знаходитися воно від лінії старту. По закінченні поділу смужку висушують і обприскують розчином реагенту, що утворює з обумовленими речовинами характерно забарвлені сполуки.
Хроматографія в тонкому шарі сорбенту аналогічна хроматографії на папері. Відмінність полягає в тому, що в цьому випадку на скляну пластинку наносять тонкий шар порошкоподібного сорбенту (наприклад, окис алюмінію, силікагель, каолін, іонообмінна смола). Техніка розділення аналізованої суміші на окремі речовини і методи якісного їх визначення в основному ті ж, що і при хроматографії на папері.
В останні роки в клінічну і лабораторну практику все ширше стали проникати так звані автоматичні аналізатори - прилади, що дозволяють зробити хроматографічний аналіз з допомогою автоматичних пристроїв з одночасним записом отриманих результатів на спеціальну стрічку.
Хроматографія (від грец. chroma, chromatos - колір, забарвлення і grapho - записую; буквально - цветопись) - сорбційний динамічний метод розділення сумішей речовин. Запропоновано М. С. Кольором в 1903 р. для аналізу пігментів рослин. Згодом став універсальним методом розділення сумішей пофарбованих і безбарвних речовин будь-якої природи в аналітичних і препаративних цілях.
Метод полягає в поглинанні вихідної суміші невеликою ділянкою зернового шару сорбенту, поміщеного в колонку, і в подальшому розсуванні зон компонентів (елюції) при пропусканні через шар сорбенту элюэнта - розчинника або розчину, не містить компонентів аналізованої суміші. При елюції компоненти суміші переміщуються по шару сорбенту з різною швидкістю і внаслідок цього разобщаются на сорбенті у вигляді ізольованих зон, а при подальшому элюировании сорбенту послідовно переходять у фільтрат (рис. 1). Хроматографія дозволяє одержувати чисті речовини, в тому числі біологічно активні (морфін, антибіотики, вітаміни, гормони, ферменти та ін). Замість колонок сорбенту часто використовують нанесений на скляну пластинку тонкий порошок (силікагель, глина, Al2O3, Mg та ін) - це тонкошарова хроматографія (ТШХ) або смуги фільтрувального паперу (хроматографія на папері). У цьому випадку компоненти суміші утворюють ізольовані плями; відношення швидкостей їх переміщення до швидкості переміщення фронту розчинника (величина Rf) характеризує природу речовини, площа - його кількість. Ці методи дозволяють розділяти і аналізувати 10-8 - 10-6 г речовини. В аналітичному аспекті хроматографія дозволяє ідентифікувати речовину на підставі зіставлення швидкостей переміщення його і «свідка» по шару сорбенту і полегшує кількісний аналіз сумішей, близьких за властивостями компонентів.
Розрізняють адсорбційну хроматографію, іонообмінну, розподільну і осадову; останнім часом до хроматографічних методів відносять метод гелевою фільтрації.
Адсорбційна хроматографія (АХ). В основі АХ лежить процес адсорбції (див.) компонентів суміші сорбентом. В АХ використовують пористі сорбенти з великою питомою поверхнею (100-1000 м2/г). АХ широко застосовують для отримання лікарських речовин, аналізу біологічних матеріалів та ін
Іонообмінна хроматографія (ІОХ). Заснована на поглинанні іонів сорбентом в результаті гетерогенної хімічної реакції іонного обміну між сорбентом і аналізованим розчином. В ІОХ використовують природні і синтетичні іонообмінні речовини (див. Іоніти), поглинання якими компонентів суміші зростає із збільшенням заряду іона компонента, а для іонів рівної величини заряду - із збільшенням радіуса іона. ІОХ - найбільш досконалий метод якісного і кількісного аналізу амінокислот і пептидів. Використання автоматичного аналізатора, в основу роботи якого покладений метод фракціонування амінокислот на сульфокатионитах за Муру, Спеккману, Стайн, дозволяє аналізувати до 60 азотовмісних сполук (рис. 2); повний аналіз, для якого достатньо 0,01-0,025 мкмоля кожної амінокислоти, здійснюється за 3-5 год.
Для розділення сумішей високомолекулярних сполук (білки, нуклеїнові кислоти, кислі полісахариди тощо) використовують іонообмінні сефадексы (СІ) або несшитые лінійні іоніти на основі целюлози (ЦИ). СІ отримують введенням залишків кислоти чи підстави готовий сополімер; отримано два катіоніту-карбоксиметил (КМЗ) і сульфоэтилсефадекс (СЕС) і аніоніт-диэтиламиноэтилсефадекс (ДЭАЭ-З). ЦИ представляють ефіри целюлози з різними іоногенними групами; широко застосовують катіоніти - карбоксиметилцелюлоза, фосфатцеллюлоза, сульфоэтилцеллюлоза; аниониты - диэтиламиноэтилцеллюлоза (ДЭАЭ-Ц, майже універсальний аніоніт), триэтиламиноэтилцеллюлоза (ТЭАЭ-Ц), слабоосновной аніоніт - ЭКТЕола-целюлоза (ЭКТЕола-Ц), отримана реакцією целюлози з эпихлоргидрином і триетаноламіном. Обмінна ємність СІ більше, ніж ЦИ, і становить 3-4,5 мг-екв/р.
За допомогою ЦИ або СІ досягнуті великі успіхи в області виділення та очищення білків, зокрема ферментів, гормонів, токсинів, нуклеїнових кислот, великих бактеріальних полісахаридів. ДЭАЭ-Ц або ЭКТЕола-Ц, нанесені тонким шаром на пластини,- кращі сорбенти для швидкого і дуже тонкого фракціонування нуклеотидів і нуклеїнових кислот.
Розподільна хроматографія (РХ). Поділ компонентів сумішей при цій хроматографії обумовлено відмінностями в їх коефіцієнтах розподілу між нерухомою фазою, утримуваної інертним сорбентом, і рухомий фазою - розчинником або газом; в останньому випадку говорять про газорозподільної хроматографії (ГРХ). РХ - найбільш поширений аналітичний і препаративний метод фракціонування близьких за будовою речовин. В якості інертного носія використовують переважно полярні речовини - целюлозу (у вигляді листів фільтрувального паперу), рідше - силікагель. Техніка хроматографії на папері дуже проста; в залежності від напрямку руху розчинника розрізняють одновимірну, двомірну або кругову хроматограммы. Рух розчинника на папері може здійснюватися висхідним, низхідним або горизонтальним способами. Анализируемую суміш наносять на папір у вигляді краплі об'ємом 1-5 мкл, містить 10-8 -10-6 г кожного визначуваної речовини. Висхідний або спадний потік розчинника переміщує компоненти суміші по папері, утворюючи ланцюжок (одновимірна хроматограма) або візерунок (двомірна хроматограма) плям (рис. 3). Зміст кожного ізольованого компонента визначають звичайними методами після екстракції речовини з «плями» або рідше безпосередньо на папері але площі плями, яка встановлюється на основі його забарвлення, радіоактивності або поглинання речовиною ультрафіолетових променів.
ГРХ дає змогу з граничною точністю аналізувати ультрамикроколичества (10-11 - 10-9 г) речовини, які в умовах аналізу можуть бути переведені в газо - чи пароподібний стан. Вона використовується для вивчення процесів дихання і складу газів крові, визначення статевих гормонів, гормонів кори надниркових залоз, жовчних кислот, жиророзчинних вітамінів, особливо вітамінів групи D (D2 - D3), ліпідів і деяких летких компонентів тканин - нижчих спиртів, тіолів, кетонів. У біохімії харчування ГРХ застосовують для ідентифікації речовин, що визначають запахи харчових продуктів, наприклад кава, сиру, смаженого м'яса і т. д.
Осадова хроматографія. При цій хроматографії відбувається утворення компонентами суміші нерозчинних опадів унаслідок їх хімічної взаємодії з реагентом, пропитывающим сорбент. У біохімічних і клінічних дослідженнях осадова хроматографія поки що застосування не знаходить.
Гель-фільтрація (ГФ). Поділ речовин методом гелевою фільтрації базується на механічному явищі молекулярного сита; при ГФ молекули, розміри яких менше діаметра пір однороднопористого набряклого «сорбенту», рівномірно розподіляються між «зовнішнім» і «внутрішнім» розчинами; великі молекули не проникають всередину зерна «сорбенту» і, отже, переміщаються по колонці зі швидкістю течії розчинника. У біохімічних дослідженнях найбільше поширення отримали пористі сополімери частково деполимеризованного бактеріального полісахариду декстрану з різною кількістю гідрофобних містків, утворених залишками гліцерину (сефадексы) або поліакриламіду (биогели). Підвищення вмісту «зшиваючого агента» зменшує розміри пір сита і набухаемость сополімеру, знижуючи поглинання їм великих молекул, зазвичай речовин з великою мовляв. вагою. Використання сефадексов різних марок дозволяє розділяти речовини з мол. вагою від 200 до 200 000, а биогелей - від 200 до 300 000. «Слабо зшиті» гелі застосовують для аналізу, виділення та очищення білків, полісахаридів, нуклеїнових кислот. «Щільно зшиті» гелі дозволяють фракционировать амінокислоти, пептиди, цукру, нуклеотиди. Дрібнопористі гелі використовують для відділення низькомолекулярних речовин від високомолекулярних і замінюють діаліз.
Розглянуті види хроматографії широко реалізуються у варіанті тонкошарової хроматографії (ТШХ), при якому тонкоподрібнений сорбент або носій наноситься шаром (0,1 - 0,3 мм) на скляну пластинку. Техніка отримання тонкошарових хроматограмм аналогічна хроматографії на папері; перевага - швидкість поділу і висока чутливість. ТШХ на силикагелях, Al2O3, кизельгуре, звичайної та іонообмінної целлюлозах або сефадексах є найдосконалішим методом мікроаналізу. ТШХ використовується в біохімічних і клінічних дослідженнях для розділення, ідентифікації і кількісного визначення амінокислот, пептидів, вуглеводів, нуклеотидів, гормонів, жирних кислот, білків і т. д.; так, наприклад, суміш АТФ і АДФ у кількості 5·10-4 мкмоля кожній може бути розділена в тонкому шарі ЭКТЕола-целюлози за 4-5 хв.; суміш чотирьох нуклеотидів розділяється в цих умовах за 15 хв. В аналітичної хімії застосовують ТШХ, при якій найбільш поширеними сорбентами служать окис алюмінію і силікагель.
Рис. 2. Хроматограмма вільних амінокислот депротеинизированной плазми крові здорової людини (1,7 мл); колонка розміром 69Х0,9 см; поділ нейтральних і кислих амінокислот.
Рис. 3. Двомірна хроматограма суміші найважливіших амінокислот, що входять до складу білків і біологічних рідин. Перший розчинник: бутанол - оцтова кислота; другий розчинник: фенол - NH3. 1 - цистеиновая кислота; 2 - аспарагінова кислота; в - глютамінова кислота; 4 - серин; 5 - таурин; в - гліцин; 7 - глютамін; 8 - треонін; 9 - аланін; 10 - β-аланін; 11 - оксипролін; 12 - тирозин; 13 - гістидин; 14 - лізин; 15 - аргінін; 16 - метіонін-сульфоксид; 17 - ү-аміномасляна кислота; 18 - β-аминоизомасляная кислота; 19 - валін; 20 - фенілаланін; 21 - ізолейцин; 22 - лейцин; 23 - пролін.
