Радіоактивність - це здатність атомів деяких ізотопів самовільно розпадатися, випускаючи випромінювання. Вперше таке випромінювання, що випускається ураном, Беккерель виявив, тому спочатку радіоактивні випромінювання називали промені Беккереля. Основний вид радіоактивного розпаду - викидання з ядра атома альфа-частинки - альфа-розпад (див. Альфа-випромінювання) або бета-частинки - бета-розпад (див. Бета-випромінювання).
При радіоактивному розпаді вихідний атом перетворюється в атом іншого елемента. В результаті викидання з ядра атома альфа-частинки, що представляє собою сукупність двох протонів і двох нейтронів, масове число утворюється атома (див.) зменшується на чотири одиниці, і він виявляється зрушеним в таблиці Менделєєва Д. І. на дві клітини ліворуч, так як порядковий номер елемента в таблиці дорівнює числу протонів у ядрі атома. При викиданні бета-частинки (електрон) відбувається перетворення в ядрі одного нейтрона в протон, внаслідок чого утворюється атом виявляється зрушеним в таблиці Менделєєва Д. І. на одну клітинку вправо. Маса його при цьому майже не змінюється. Викидання бета-частинки пов'язане зазвичай з гамма-випромінюванням (див.).
Розпад будь-якого радіоактивного ізотопу відбувається за наступним законом: число, що розпадаються в одиницю часу атомів (n) пропорційно числу атомів (N), наявних в даний момент часу, тобто n=λN; коефіцієнт λ, називається постійної радіоактивного розпаду і пов'язаний з періодом напіврозпаду ізотопу (Т) співвідношенням λ= 0,693/T. Зазначений закон розпаду призводить до того, що за кожен відрізок часу, рівний періоду напіврозпаду Т, кількість ізотопу зменшується вдвічі. Якщо утворюються в результаті радіоактивного розпаду атоми виявляються теж радіоактивними, то відбувається їх поступове накопичення, поки не встановиться радіоактивна рівновага між материнським і дочірнім ізотопами; при цьому число атомів дочірнього ізотопи, що утворюються в одиницю часу, дорівнює числу атомів, що розпадаються за той же час.
Відомо понад 40 природних радіоактивних ізотопів. Велика частина їх розташована в трьох радіоактивних рядах (колекцій): урану-радію, торію і актинія. Всі зазначені радіоактивні ізотопи широко поширені в природі. Присутність їх в гірських породах, водах, атмосфері, рослинних і живих організмах обумовлює природну або природну радіоактивність.
Крім природних радіоактивних ізотопів, зараз відомо близько тисячі штучно радіоактивних. Отримують їх шляхом ядерних реакцій, в основному в ядерних реакторах (див. Реактори ядерні). Багато природні і штучно радіоактивні ізотопи широко використовуються в медицині для лікування (див. Променева терапія) і особливо для діагностики захворювань (див. Радіоізотопна діагностика). См. також іонізуючі Випромінювання.
Радіоактивність (від лат. radius - промінь і activus - діючий) - здатність нестійких ядер атомів спонтанно перетворюватися в інші, більш стійкі або стабільні ядра. Такі перетворення ядер називаються радіоактивними, а самі ядра або відповідні атоми - радіоактивними ядрами (атомами). При радіоактивних перетвореннях ядра випромінюють енергію або у вигляді заряджених частинок, або у вигляді гамма-квантів електромагнітного випромінювання або гамма-випромінювання.
Перетворення, при яких ядро одного хімічного елемента перетворюється на ядро іншого елемента з іншим значенням атомного номера, називають радіоактивним розпадом. Радіоактивні ізотопи (див.), що утворилися й існують у природних умовах, називають природно радіоактивними; такі ж ізотопи, отримані штучним шляхом за допомогою ядерних реакцій,- штучно радіоактивними. Між природно і штучно радіоактивними ізотопами немає принципової різниці, так як властивості ядер атомів і самих атомів визначаються складом і структурою ядра і не залежать від способу їх утворення.
Радіоактивність була відкрита в 1896 р. Беккерелем (А. Н. Becquerel), який виявив випромінювання урану (див.), здатне викликати почорніння фотоемульсії і іонізувати повітря. Кюрі-Склодовська (М. Curie-Sklodowska) перша зміряла інтенсивність випромінювання урану і одночасно з німецьким вченим Шмідтом (G. С. Schmidt) виявила радіоактивність у торію (див.). Властивість ізотопів мимовільно випускати невидиме випромінювання подружжя Кюрі назвали радіоактивністю. У липні 1898 р. вони повідомили про відкриття ними в уранової смоляної руді нового радіоактивного елемента полонію (див.). У грудні 1898 р. спільно з Бемоном (G. Bemont) вони відкрили радій (див.).
Після відкриття радіоактивних елементів ряд авторів (Беккерель, подружжя Кюрі, Резерфорд та ін) встановив, що ці елементи можуть випускати три види променів, які по-різному поводяться в магнітному полі. За пропозицією Резерфорда (Е. Rutherford, 1902) ці промені були названі альфа- (див. Альфа-випромінювання), бета- (див. Бета-випромінювання) і гамма-променями (див. Гамма-випромінювання). Альфа-промені складаються з позитивно заряджених альфа-частинок (двічі іонізованих атомів гелію Не4); бета-промені - з негативно заряджених частинок малої маси електронів; гамма-промені за природою аналогічні рентгеновым променів і являють собою кванти електромагнітного випромінювання.
У 1902 р. Резерфорд і Содді (F. Soddy) пояснили явище радіоактивності довільним перетворенням атомів одного елемента в атоми іншого елемента, відбувається за законами випадковості і супроводжується виділенням енергії у вигляді альфа-, бета-і гамма-променів.
У 1910 р. М. Кюрі-Склодовська разом з Дебьерном (A. Debierne) отримала чистий металевий радій і досліджувала його радіоактивні властивості, зокрема зміряла постійну розпаду радію. Незабаром був відкритий ряд інших радіоактивних елементів. Дебьерн і Гізель (F. Giesel) відкрили актиній. Ган (О. Halm) відкрив радиоторий і мезоторий, Болтвуд (Ст. Ст. Boltwood) відкрив ионий, Ган і Майтнер (L. Meitner) відкрили протактиний. Всі ізотопи цих елементів радіоактивні. У 1903 р. П'єр Кюрі і Лаборд (С. A. Laborde) показали, що препарат радію завжди має підвищену температуру і що 1 г радію з продуктами його розпаду за 1 годину виділяє близько 140 ккал. У цьому ж році Рамзай (W. Ramsay) і Содді встановили, що в запаяній ампулі з радієм міститься газоподібний гелій. Роботами Резерфорда, Дорна (F. Dorn), Дебьерна і Гізеля було показано, що серед продуктів розпаду урану і торію є быстрораспадающиеся радіоактивні гази, названі еманаціями радію, торію і актинія (радон, торон, актинон). Таким чином, було доведено, що при розпаді атоми радію перетворюються в атоми гелію і радону. Закони радіоактивних перетворень одних елементів в інші при альфа - і бета-распадах (закони зміщення) були вперше сформульовані Содді, Фаянсом (К. Fajans) і Расселлом (W. J. Russell).
Ці закони полягають у наступному. При альфа-розпаді завжди з початкового елемента виходить інший, який розташований у періодичній системі Менделєєва Д. І. на дві клітини ліворуч від початкового елемента (порядковий або атомний номер на 2 менше вихідного); при бета-розпаді завжди з початкового елемента виходить інший елемент, який розташований у періодичній системі на одну клітинку праворуч початкового елемента (атомний номер на одиницю більше, ніж у вихідного елемента).
Вивчення перетворень радіоактивних елементів призвело до відкриття ізотопів, тобто атомів, що володіють однаковими хімічними властивостями і атомними номерами, але відрізняються один від одного по масі і по фізичним властивостям, зокрема за радіоактивним властивостями (типу випромінювання, швидкості розпаду). З великої кількості відкритих радіоактивних речовин новими елементами виявилися тільки радію (Ra), радон (Rn), полоній (Рв) і протактиний (Ра), а решта - ізотопами раніше відомих урану (U), торія (Th), свинцю (Pb), талія (Tl) та вісмуту (Bi).
Після відкриття Резерфордом ядерної структури атомів і докази, що саме ядро визначає всі властивості атома, зокрема структуру його електронних оболонок і його хімічні властивості (див. Атом, атомне Ядро), стало ясно, що радіоактивні перетворення пов'язані з перетворенням атомних ядер. Подальше вивчення будови атомних ядер дозволило повністю розшифрувати механізм радіоактивних перетворень.
Перше штучне перетворення ядер - ядерна реакція (див.) - була здійснена Резерфордом у 1919 р. шляхом бомбардування ядер атомів азоту альфа-частинками полонію. При цьому ядра азоту випускали протони (див.) і перетворювалися на ядра кисню О17. У 1934 р. Ф. Жоліо-Кюрі і В. Жоліо-Кюрі (F. Joliot-Curie, I. Joliot-Curie) вперше отримали штучним шляхом радіоактивний ізотоп фосфору бомбардуючи альфа-частинками атоми Al. Ядра P30 на відміну від ядер природно радіоактивних ізотопів, при розпаді випускали не електрони, а позитрони (див. Космічне випромінювання) і перетворювалися на стабільні ядра кремнію Si30. Таким чином, в 1934 р. були одночасно відкриті штучна радіоактивність і новий вид радіоактивного розпаду - позитронний розпад, або β+-розпад.
Подружжя Жоліо-Кюрі висловили думку про те, що всі швидкі частинки (протони, дейтоны, нейтрони) викликають ядерні реакції і можуть бути використані для отримання природно радіоактивних ізотопів. Фермі (Е. Fermi) з співр., бомбардуючи нейтронами різні елементи, отримав радіоактивні ізотопи майже всіх хімічних елементів. В даний час за допомогою прискорених заряджених частинок (див. Прискорювачі заряджених частинок) і нейтронів здійснено велику різноманітність ядерних реакцій, в результаті яких стало можливим одержувати будь-які радіоактивні ізотопи.
У 1937 р. Альварес (L. Alvarez) відкрив новий вид радіоактивного перетворення - електронний захоплення. При електронному захопленні ядро атома захоплює електрон з оболонки атома і перетворюється в ядро іншого елемента. У 1939 р. Ган і Штрассманн (F. Strassmann) відкрили поділ ядра урану на більш легкі ядра (осколки поділу) при бомбардуванні його нейтронами. У тому ж році Флеров і Петржак показали, що процес розподілу ядер урану здійснюється і без зовнішнього впливу, мимовільно. Тим самим вони відкрили новий вид радіоактивного перетворення - самовільний поділ важких ядер.
В даний час відомі наступні види радіоактивних перетворень, що здійснюються без зовнішніх впливів, мимовільно, в силу внутрішніх причин, обумовлених структурою атомних ядер.
1. Альфа-розпад. Ядро з атомним номером Z і масовим числом А випускає альфа-частинку - ядро гелію Не4 - і перетворюється в інше ядро з Z меншим на 2 одиниці і А меншим на 4 одиниці, ніж у вихідного ядра. У загальному вигляді альфа-розпад записується наступним чином:![]()
де X - початкове ядро, Y-ядро продукту розпаду.
2. Бета-розпад буває двох типів: електронний і позитронний, або β-і β+-розпад (див. Бета-випромінювання). При електронному розпаді з ядра вилітає електрон і нейтрино і утворюється нове ядро з тим же масовим числом А, але з атомним номером Z на одиницю більшим, ніж у вихідного ядра:![]()
При позитронному розпаді ядро випромінює позитрон і нейтрино і утворюється нове ядро з тим же масовим числом, але з Z на одиницю меншим, ніж у вихідного ядра:![]()
При бета-розпаді в середньому 2/3 енергії ядра несеться частинками нейтрино (нейтральними частинками дуже малої маси, дуже слабо взаємодіють з речовиною).
3. Електронний захоплення (колишня назва К-захоплення). Ядро захоплює електрон з однієї з оболонок атома, найчастіше з К-оболонки, випускає нейтрино і перетворюється в нове ядро з тим же масовим числом А, але з атомним номером Z менше на 1, ніж у вихідного ядра.![]()
Перетворення ядер при електронному захопленні і позитронному розпаді однакове, тому ці два види розпаду спостерігаються одночасно для одних і тих же ядер, тобто є конкуруючими. Так як після захоплення електрона з внутрішньої оболонки атома на його місце електрон переходить з однієї з більш віддалених від ядра орбіти, то електронний захоплення завжди супроводжується випущенням рентгенівського характеристичного випромінювання.
4. Изомерный перехід. Після випущення альфа - чи бета-частинки деякі типи ядер знаходяться в збудженому стані (стані з надлишковою енергією) і випускають енергію збудження у вигляді гамма-квантів (см.Гамма-випромінювання). У цьому випадку при радіоактивному розпаді ядро, крім альфа - чи бета-частинок, випускає також гамма-кванти. Так, ядра ізотопу Sr90 випускають тільки β-частки, ядра Na24 випускають, крім β-частинок, також гамма-кванти. Більшість ядер знаходиться в збудженому стані дуже малі проміжки часу, що не піддаються вимірюванню (менше 10-9 сек.). Однак лише відносно невелике число ядер може перебувати у збудженому стані порівняно великі проміжки часу - до декількох місяців. Такі ядра називаються ізомерами, а відповідні переходи їх із збудженого стану в нормальний, супроводжуються випусканням тільки гамма-квантів,- ізомерних. При ізомерних переходах А і Z ядра не змінюються. Радіоактивні ядра, що випускають тільки альфа - чи бета-частинки, що називаються чистими альфа - або бета-випромінювачами. Ядра, в яких альфа - або бета-розпад супроводжується випусканням гамма-квантів, називаються гама-випромінювачами. Чистими гамма-випромінювачами є тільки ядра, що знаходяться тривалий час у збудженому стані, тобто переживають ізомерні переходи.
5. Самовільне ділення ядер. В результаті ділення з одного ядра утворюється два легших ядра - осколки ділення. Так як однакові ядра можуть ділитися різним чином на два ядра, то в процесі поділу утворюється багато різних пар більш легких ядер з різними Z і А . При поділі звільняються нейтрони, в середньому 2-3 нейтрона на один акт поділу ядра, і гамма-кванти. Всі утворюються при поділі осколки є нестійкими і зазнають β--розпад. Ймовірність поділу є дуже малою для урану, але зростає зі збільшенням Z. Цим пояснюється відсутність на Землі більш важких, ніж уран, ядер. В стабільних ядрах існує певне співвідношення між числом протонів і нейтронів, при якому ядро володіє найбільшою стійкістю, тобто найбільшою енергією зв'язку частинок в ядрі. Для легких і середніх ядер найбільшою їх стійкості відповідає приблизно однаковий вміст протонів і нейтронів. Для більш важких ядер спостерігається відносне збільшення числа нейтронів в стійких ядрах. При надлишку в ядрі протонів або нейтронів ядра з середнім значенням А є нестійкими і зазнають β-- або β+-розпади, при яких відбувається взаємне перетворення нейтрона і протона. При надлишку нейтронів (важкі ізотопи) відбувається перетворення одного з нейтронів в протон з випусканням електрони і нейтрино:![]()
При надлишку протонів (легкі ізотопи) відбувається перетворення одного з протонів в нейтрон з випусканням або позитрона і нейтрино (β+-розпад), або тільки нейтрино (електронний захоплення):
Всі важкі ядра з атомним номером більше, чого Pb82, є нестійкими внаслідок значної кількості протонів, відштовхують один одного. Ланцюжка послідовних альфа - і бета-розпадів в цих ядрах відбуваються до тих пір, поки не утворюються стійкі ядра ізотопів свинцю. З поліпшенням експериментальної техніки у все більшої кількості ядер, які вважалися раніше стабільними, виявляють дуже повільний радіоактивний розпад. В даний час відомо 20 радіоактивних ізотопів з Z менше 82.
В результаті будь-яких радіоактивних перетворень кількість атомів даного ізотопу безперервно зменшується. Закон убування з плином часу кількості активних атомів (закон радіоактивного розпаду) є загальним для всіх видів перетворень і всіх ізотопів. Він носить статистичний характер (застосуємо тільки для великої кількості радіоактивних атомів) і полягає в наступному. Кількість активних атомів даного ізотопу, що розпадаються за одиницю часу ΔN/Δt, пропорційно кількості активних атомів N, тобто за одиницю часу розпадається завжди одна і та ж частка до активних атомів даного ізотопу незалежно від їх кількості. Величина к називається постійної радіоактивного розпаду і являє собою частку активних атомів, що розпадаються за одиницю часу, чи відносну швидкість розпаду. до вимірюється в одиницях, зворотних одиниць вимірювання часу, тобто в сек.-1 (1/сек.), добу-1, рік-1 і т. п., для кожного радіоактивного ізотопу має своє певне значення, яке змінюється в дуже широких межах для різних ізотопів. Величина, що характеризує абсолютну швидкість розпаду, називається активністю даного ізотопу або препарату. Активність 1 г речовини, називається питомою активністю речовини.
Із закону радіоактивного розпаду випливає, що зниження кількості активних атомів N спочатку відбувається швидко, а потім повільніше. Час, протягом якого кількість активних атомів або активність даного ізотопу зменшується вдвічі, називається періодом напіврозпаду (Т) даного ізотопу. Закон убування N від часу t є експоненціальним і має наступний аналітичний вираз: N=N0e-λt, де N0 - число активних атомів в момент початку відліку часу (р=0), N - кількість активних атомів через час t, е - основа натуральних логарифмів (число, рівне 2,718...). Між постійної розпаду до і періодом напіврозпаду λ існує наступне співвідношення: λТ-0,693. Звідси![]()
Періоди напіврозпаду вимірюються в сек., хв. і т. п. і для різних ізотопів змінюються в дуже широких межах від малих часток секунди до 10+21 років. Ізотопи, що володіють великими λ і малими Т, називаються короткоживущими, ізотопи з
малими λ і великими Т називаються довгоживучими. Якщо активна речовина складається з кількох радіоактивних ізотопів з різними періодами напіврозпаду, генетично не пов'язаних між собою, то з плином часу активність речовини також буде безперервно зменшуватися і ізотопний склад препарату буде весь час змінюватися: буде зменшуватися частка короткоживучих ізотопів і зростати частка довгоживучих ізотопів. Через досить великий проміжок часу практично в препараті залишиться тільки самий довгоживучий ізотоп. За кривими розпаду радіоактивних речовин, що складаються з одного або суміші ізотопів, можна визначити періоди напіврозпаду окремих ізотопів та їх відносні активності для будь-якого моменту часу.
Закони зміни активності генетично пов'язаних ізотопів якісно інші; вони залежать від співвідношення періодів їх напіврозпаду. Для двох генетично пов'язаних ізотопів з періодом Т1 для вихідного ізотопу і Т2 - продукту розпаду ці закони мають найбільш просту форму. При T1>T2 активність вихідного ізотопу Q1 весь час зменшується по експоненціальному закону з періодом напіврозпаду Т1. Завдяки розпаду ядер вихідного ізотопу будуть утворюватися ядра кінцевого ізотопу і його активність Q2 буде зростати. Через певний час швидкість розпаду ядер другого ізотопу (стане близькою до швидкості утворення ядер цього ізотопу з вихідного (швидкість розпаду вихідного ізотопу Q1) і ці швидкості будуть знаходитися в певному та постійному співвідношенні весь подальший час - настає радіоактивна рівновага.
Активність вихідного ізотопу безперервно зменшується з періодом Т1, тому після досягнення радіоактивного рівноваги активність кінцевого ізотопу Q2 та сумарна активність двох ізотопів Q1+Q2 будуть спадати з періодом напіврозпаду вихідного ізотопу Т1. При Т1>Т2 Q2=Q1. Якщо з вихідного долгоживущего ізотопу утворюється послідовно кілька короткоживучих ізотопів, як це має місце в радіоактивному ряду урану і радію, то після досягнення рівноваги активності кожного короткоживучого ізотопу стають практично рівними активності вихідної ізотопу. При цьому загальна активність дорівнює сумі всіх активностей короткоживучих продуктів розпаду і зменшується з періодом: напіврозпаду вихідного долгоживущего ізотопу, як і активність всіх ізотопів, що перебувають у рівновазі.
Радіоактивна рівновага досягається практично за час, що дорівнює 5-10 періодами напіврозпаду того ізотопу з продуктів розпаду, який має найбільший період напіврозпаду. Якщо T1<T2, то рівновага не може бути здійснено, так як ніколи не досягне сталості співвідношення між активностями цих ізотопів. Ставлення Q1 : Q2 буде безперервно падати з плином часу від ∞ до 0. Практичний інтерес представляє випадок радіоактивного рівноваги, так як воно має місце у всіх ланцюжках розпаду природно радіоактивних елементів: в рядах урану - радію, торію і актинія і в еталонних препарати радію з продуктами його розпаду (див. Радій).
До числа природно радіоактивних ізотопів належить близько 40 ізотопів періодичної системи елементів з Z більше 82, які утворюють три ряду послідовних радіоактивних перетворень: ряд урану (рис. 1), ряд торію (рис. 2) і ряд актинія (рис. 3). Шляхом послідовних альфа - і бета-розпадів з вихідних ізотопів ряду виходять кінцеві стійкі ізотопи свинцю.

Рис. 1. Ряд урану.
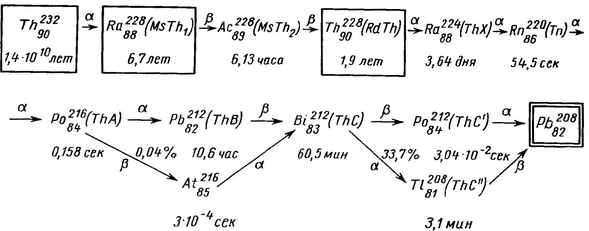
Рис. 2. Ряд торію.
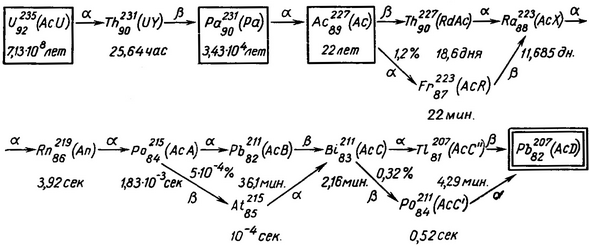
Рис. 3. Ряд актинія.
Стрілками вказані на малюнках послідовні радіоактивні перетворення із зазначенням типу розпаду і відсотка атомів, що перетерплюють розпад даного типу. Горизонтальними стрілками позначені перетворення, які відбуваються майже в 100% випадків, а похилими - в незначній частині випадків. При позначенні ізотопів вказані періоди їх напіврозпаду. У дужках дані колишні назви членів ряду, вказують генетичний зв'язок, без дужок - прийняті в даний час позначення ізотопів, відповідні їх хімічної та фізичної природи. В рамках укладені довгоживучі ізотопи, а в подвійні рамки - кінцеві стабільні ізотопи. Альфа-розпад зазвичай супроводжується дуже малоінтенсивним гамма-випромінюванням, частина бета-випромінювачів випускає інтенсивне гамма-випромінювання. Природний фон обумовлений природною радіоактивністю-випромінюванням і впливом природно радіоактивних ізотопів, що містяться на поверхні Землі, в біосфері і в повітрі, і космічним випромінюванням (див.). Крім зазначених ізотопів, в різних речовинах містяться також ізотоп К40 і близько 20 інших радіоактивних ізотопів з дуже великими періодами напіврозпаду (від 109 до 1021 років), унаслідок чого їхня відносна активність дуже мала порівняно з активністю інших ізотопів.
Радіоактивні ізотопи, що містяться в оболонці Землі, грали і відіграють виняткову роль в розвитку нашої планети, зокрема в розвитку і збереженні життя, так як вони компенсували втрати тепла, що відбуваються на Землі, і забезпечували практичне сталість температури на планеті протягом багатьох мільйонів років. Радіоактивні ізотопи, подібно всім іншим ізотопів, що містяться в природі в основному в розсіяному стані і присутні у всіх речовинах, рослинних і тваринних організмах.
Внаслідок відмінності фізико-хімічних властивостей ізотопів відносний вміст їх в ґрунтах і водах виявляється неоднаковим. Газоподібні продукти розпаду урану, торію і актинія - торон, радон і актинон - з грунтових вод безперервно поступають в повітря. Крім цих газоподібних продуктів, в повітрі містяться також альфа - і бета-активні продукти розпаду радію, торію і актинія (у вигляді аерозолів). З грунту радіоактивні елементи, як і стабільні, разом з грунтовими водами надходять у рослини, тому стебла і листя рослин завжди містять уран, радій, торій з продуктами їх розпаду, калію і ряд інших ізотопів, хоча і у відносно малих концентраціях. В рослинах і тваринних також присутні ізотопи С14, Н3, Be7 та інші, які утворюються в повітрі під впливом нейтронів космічного випромінювання. Внаслідок того що відбувається безперервний обмін між організмом і навколишнім середовищем, що всі радіоактивні ізотопи, які містяться в харчових продуктах, воді та повітрі, містяться і в організмі. Ізотопи знаходяться в організмі в наступних дозах: у м'яких тканинах-31 мбер/рік, у кістках-44мбэр/рік. Доза від космічного випромінювання складає 80-90 мбер/рік, доза від зовнішнього гамма-випромінювання - 60-80 мбер/рік. Сумарна доза дорівнює 140-200 мбер/рік. Доза, падаюча на легені, - 600-800 мбер/рік.
Штучно радіоактивні ізотопи виходять шляхом бомбардування стабільних ізотопів нейтронами або зарядженими частинками в результаті різних ядерних реакцій, в якості джерел заряджених частинок використовуються різні типи прискорювачів.
Про вимірювання потоків і доз різних видів іонізуючих випромінювань - див. Дозиметрія, Дози іонізуючих випромінювань, Нейтрон.
Внаслідок того що великі дози радіації шкідливо позначаються на здоров'ї людей, при роботі з джерелами випромінювань і радіоактивними ізотопами застосовуються спеціальні заходи захисту (див. Противолучевая захист).
В медицині і біології ізотопи використовують для вивчення обміну речовин, діагностичних і терапевтичних цілях (див. Променева терапія). Вміст радіоактивних ізотопів у організмі та динаміку їх обміну визначають за допомогою лічильників зовнішнього випромінювання від людини.
