 Д. І. Менделєєв |
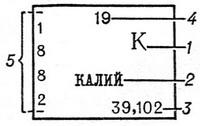 Умовні позначення до кольоровий таблиці: 1 - хімічний символ елемента; 2 - назва; 3 - атомна маса (атомна вага); 4 - порядковий номер; 5 - розподіл електронів по верствам. |
Періодична система хімічних елементів - класифікація хімічних елементів, створена Д. І. Менделєєвим на основі відкритого ним в 1869 р. періодичного закону.
Згідно сучасної формулюванні цього закону, в безперервному ряду елементів, розміщених у порядку зростання величини позитивного заряду ядер їх атомів, що періодично повторюються елементи з подібними властивостями.
Періодична система хімічних елементів, представлена у вигляді таблиці, складається з періодів, рядів і груп.
На початку кожного періоду (за винятком першого) знаходиться елементі яскраво вираженими металічними властивостями (лужний метал).
У міру зростання порядкового номера елемента, рівного величині позитивного заряду ядра його атома, поступово слабшають металеві і наростають неметалічні властивості. Передостаннім елементом в кожному періоді є елемент з яскраво вираженими неметалевими властивостями (галоген), а останнім - інертний газ. У I періоді знаходяться 2 елемента, в II і III - з 8 елементів, IV і V - за 18, у VI - 32 і VII (не завершеному періоді) - 17 елементів.
Перші три періоду називають малими періодами, кожний з них складається з одного горизонтального ряду; решта - великими періодами, кожний з яких (виключаючи VII період) складається з двох горизонтальних рядів - парного (верхнього) і непарного (нижнього). У парних рядах великих періодів знаходяться тільки метали. Властивості елементів в цих рядах із зростанням порядкового номера змінюються слабо. Властивості елементів у непарних рядах великих періодів змінюються. У VI періоді за лантаном слідують 14 елементів, дуже схожих за хімічним властивостям. Ці елементи, що називаються лантаноїдами, наведено окремо під основною таблицею. Аналогічно представлені в таблиці і актиноиды - елементи, наступні за актинием.

В таблиці є дев'ять вертикальних груп. Номер групи, за рідкісним винятком, дорівнює вищої позитивної валентності елементів даної групи. Кожна група, виключаючи нульову і восьму, підрозділяється на підгрупи. - головну (розташована праворуч) і побічну. У головних підгрупах із збільшенням порядкового номера посилюються металеві і слабшають неметалічні властивості елементів.
Таким чином, хімічні і ряд фізичних властивостей елементів визначаються місцем, яке займає даний елемент у періодичній системі.
Біогенні елементи, тобто елементи, що входять до складу організмів і виконують у ньому певну біологічну роль, займають верхню частину таблиці Менделєєва. В блакитний колір забарвлені клітини, займані елементами, що становлять основну масу (понад 99%) живої речовини, у рожевий колір - клітини, займані мікроелементами (див.).
Періодична система хімічних елементів є найбільшим досягненням сучасного природознавства і яскравим вираженням найбільш загальних діалектичних законів природи.
См. також Атом, Атомний вагу.
Періодична система хімічних елементів - природна класифікація хімічних елементів, створена Д. І. Менделєєвим на основі відкритого ним в 1869 р. періодичного закону.
У первісній формулюванні періодичний закон Менделєєва Д. І. стверджував: властивості хімічних елементів, а також форми і властивості їх сполук перебувають у періодичній залежності від величини атомних ваг елементів. В подальшому з розвитком вчення про будову атома було показано, що більш точною характеристикою кожного елемента є не атомна вага (див.), а величина позитивного заряду ядра атома елемента, що дорівнює порядкового (атомного) номера елемента в періодичній системі Менделєєва Д. І.. Число позитивних зарядів ядра атома дорівнює числу електронів, що оточують ядро атома, оскільки атоми в цілому електронейтральні. У світлі цих даних періодичний закон формулюється так: властивості хімічних елементів, а також форми і властивості їх сполук перебувають у періодичній залежності від величини позитивного заряду ядер їх атомів. Це означає, що в безперервному ряду елементів, розміщених у порядку зростання позитивних зарядів ядер їх атомів, будуть періодично повторюватися елементи з подібними властивостями.
Таблична форма періодичної системи хімічних елементів представлена в її сучасному вигляді. Вона складається з періодів, рядів і груп. Період представляє послідовний горизонтальний ряд елементів, розташованих у порядку зростання позитивного заряду ядер їх атомів.
На початку кожного періоду (за винятком першого) знаходиться елемент з яскраво вираженими металічними властивостями (лужний метал). Потім у міру збільшення порядкового номера поступово слабшають металеві і наростають неметалічні властивості елементів. Передостаннім елементом в кожному періоді є елемент з яскраво вираженими неметалевими властивостями (галоген), а останнім - інертний газ. I період складається з двох елементів, роль лужного металу і галогену тут одночасно виконує водень. II і III періоди включають по 8 елементів, названих Менделєєвим типовими. IV і V періоди налічують по 18 елементів, VI-32. VII період ще не завершений і поповнюється штучно створюваними елементами; в даний час в цьому періоді налічується 17 елементів. I, II та III періоди називають малими, кожен з них складається з одного горизонтального ряду, IV-VII - великими: вони (за винятком VII) включають два горизонтальних ряди - ний (верхній) і непарні (нижній). У парних рядах великих періодів знаходяться тільки метали, і зміна властивостей елементів у ряду зліва направо виражено слабо.
У непарних рядах великих періодів властивості елементів в ряду змінюються так само, як властивості типових елементів. У парнім ряду VI періоду після лантану слід 14 елементів [званих лантанидами (див.), лантаноїдами, рідкоземельними елементами], подібних за хімічними властивостями з лантаном і між собою. Перелік їх наводиться окремо під таблицею.
Окремо виписані і наведені під таблицею елементи, наступні за актинием - актиниды (актиноиды).
У періодичній системі хімічних елементів по вертикалях розташовано дев'ять груп. Номер групи дорівнює вищої позитивної валентності (див.) елементів цієї групи. Виняток становлять фтор (буває тільки негативно одновалентным) і бром (не буває семивалентным); крім того, мідь, срібло, золото можуть виявляти валентність більше +1 (Cu-1 і 2, Ag і Au-1 і 3), а з елементів VIII групи валентністю +8 володіють тільки осмій і рутеній. Кожна група, за винятком восьмий і нульовою, ділиться на дві підгрупи: головну (розташована праворуч) і побічну. У головні підгрупи входять типові елементи і елементи великих періодів, побічні - тільки елементи великих періодів і притому метали.
За хімічними властивостями елементи кожної підгрупи цієї групи значно відрізняються один від одного і тільки вища позитивна валентність однакова для всіх елементів даної групи. У головних підгрупах зверху вниз посилюються металічні властивості елементів і слабшають неметалічні (так, францій є елементом з найбільш яскраво вираженими металічними властивостями, а фтор - неметалевими). Таким чином, місце елемента в П. с. х. е. (порядковий номер) визначає його властивості, які являють собою середнє з властивостей сусідніх елементів по вертикалі і горизонталі.
Деякі групи елементів мають особливі назви. Так, елементи головних підгруп I групи називають лужними металами, II групи - лужно-земельними металами, VII групи - галогенами, елементи, розташовані за ураном,- трансурановими. Елементи, які входять до складу організмів, беруть участь у процесах обміну речовин та мають явно вираженою біологічною роллю, називають біогенними елементами. Всі вони займають верхню частину таблиці Менделєєва Д. І.. Це в першу чергу Про, З, Н, N, Са, Р, К, S, Na, Cl, Mg і Fe, що складають основну масу живої речовини (більше 99%). Місця, зайняті цими елементами в П. с. х. е., пофарбовані в світло-блакитний колір. Біогенні елементи, яких в організмі дуже мало (від 10-3 до 10-14%), називають мікроелементами (див.). У клітинах П. с. х. е., забарвленого в жовтий колір, поміщені мікроелементи, життєво важливе значення яких для людини доведено.
| Н-10,0 З-20,0 N-3,0 O-63,0 |
Na-0,15 Mg-0,04 Р-1,0 S-0,2 |
Cl-0,15 К-0,25 Са-1,5 Fe-0,004 |
Відповідно до теорії будови атомів (див. Атом) хімічні властивості елементів залежать в основному від числа електронів на зовнішній електронній оболонці. Періодична зміна властивостей елементів із збільшенням позитивного заряду атомних ядер пояснюється періодичним повторенням будови зовнішньої електронної оболонки (енергетичного рівня) атомів.
У малих періодах з зростанням позитивного заряду ядра зростає число електронів на зовнішній оболонці від 1 до 2 в I періоді і від 1 до 8, у II та III періодах. Звідси зміна властивостей елементів у періоді від лужного металу до інертного газу. Зовнішня електронна оболонка, що містить 8 електронів, є завершеною та енергетично стійкою (елементи нульової групи хімічно інертні).
У великих періодах у парних рядах із зростанням позитивного заряду ядер число електронів на зовнішній оболонці залишається постійним (1 або 2) і йде заповнення електронами другий зовні оболонки. Звідси повільне зміна властивостей елементів у парних рядах. У непарних рядах великих періодів із збільшенням заряду ядер йде заповнення електронами зовнішньої оболонки (від 1 до 8) і властивості елементів змінюються так, як і у типових елементів.
Число електронних оболонок в атомі дорівнює номеру періода. Атоми елементів головних підгруп мають на зовнішніх оболонках число електронів, що дорівнює номеру групи. Атоми елементів побічних підгруп містять на зовнішніх оболонках один або два електрона. Цим пояснюється відмінність у властивостях елементів головної і побічної підгруп. Номер групи вказує можливе число електронів, які можуть брати участь в утворенні хімічних (валентних) зв'язків (див. Молекула), тому такі електрони називають валентними. В елементів побічних підгруп валентними є не тільки електрони зовнішніх оболонок, але і передостанніх. Число і будова електронних оболонок зазначено, що додається періодичній системі хімічних елементів.
Періодичний закон Менделєєва Д. І. і заснована на ньому П. с. х. е. мають винятково велике значення в науці і практиці. Періодичний закон і П. с. х. е. з'явилися основою для відкриття нових хімічних елементів, точного визначення їх атомних ваг, розвитку вчення про будову атомів, установлення геохімічних законів розподілу елементів у земній корі та розвитку сучасних уявлень про живу речовину, склад якого і пов'язані з ним закономірності знаходяться у відповідності з П. с. х. е. Біологічна активність елементів і їх вміст в організмі також багато в чому визначаються місцем, яке вони займають у П. с. х. е. Так, із збільшенням порядкового номера у ряді груп зростає токсичність елементів і зменшується їх вміст в організмі. Періодичний закон є яскравим вираженням найбільш загальних діалектичних законів розвитку природи.
